As células-tronco
O que são?
As células-tronco, do inglês stem cells, são células que ainda não atingiram a fase de maturação onde ocorre a sua especialização, ou seja, não possuem função definida e nem adquiriram características fenotípicas de nenhum tecido específico.
As características mais relevantes desse tipo de célula são a capacidade de diferenciação em qualquer tipo celular e também a autorrenovação através da duplicação (LEMISCHKA, 2005).
Quais são os tipos?
Quanto sua origem, as células-tronco podem ser tanto embrionárias (CTE), encontradas na fase embrionária de blastocisto; quanto adultas (CTA), encontradas principalmente na medula óssea (dividindo-se nesta em hematopoiéticas e estromais ou mesenquimais) e no sangue do cordão umbilical.
As CTA também estão disponíveis em menor quantidade na corrente sanguínea, no fígado, no sistema nervoso e no tecido epitelial, dentre outros tecidos, sendo, no entanto, consideradas de obtenção invasiva para aplicação nas pesquisas biomédicas (KOLIOS; MOODLEY, 2013).
- As células-tronco embrionárias são do tipo totipotentes, ou seja, podem originar qualquer tecido do corpo humano, abrangendo os 216 tipos celulares descritos, incluindo a placenta e os anexos embrionários.
Durante a fase embrionária, passados aproximadamente cinco dias, deixam de ter essa característica, uma vez que já se especializaram majoritariamente em tecido cardíaco e sistema nervoso (ainda em desenvolvimento) (BAKER; PERA, 2018).
Quando se fala em células-tronco embrionárias, nos deparamos com os conflitos éticos da possível utilização de um ser vivo em fase embrionária para qualquer outro fim que não seja seu desenvolvimento e nascimento.
A versatilidade dessas células fica em segundo plano, dando lugar às discussões sobre os limites da pesquisa (DE MIGUEL-BERIAIN, 2015). Nesse sentido, muitos pesquisadores lançam mão da utilização dos anexos embrionários para a obtenção das células-tronco, como é o caso da placenta.
Diversos tipos de células-tronco podem ser isolados da placenta, como por exemplo as células epiteliais da membrana amniótica humana. As suas principais características atrativas são capacidade de diferenciação semelhante a de células-tronco embrionárias e propriedades imunomodulatórias semelhantes a de células-tronco adultas (MIKI, 2018).
- Já as células-tronco adultas são conhecidas como multi ou pluripotentes, originando quase todos os tipos celulares, excetuando-se os anexos embrionários e a placenta (CLEVERS, 2015).
- Um terceiro e mais recente tipo de células-tronco são as pluripotentes induzidas (iPSC), ou seja, estimuladas sinteticamente em laboratório (OHNUKI; TAKAHASHI, 2015).
A indefinição da controvérsia ética tornou as iPSC humanas mais atraentes do que as CTE humanas para análises de fármacos e estudos relacionados à toxicologia e, com o tempo, as linhagens celulares disponíveis em bancos de iPSC humanas provavelmente assumirão o lugar das CTE humanas.
Ainda assim, atualmente, as CTE humanas são indispensáveis, pois os seus resultados em ensaios clínicos constituem o padrão-ouro para qualquer futura terapia celular baseada em iPSC (ILIC; OGILVIE, 2017).
Tenha acesso a conteúdos atualizados e práticos dentro da comunidade Redpill –https://drvitorazzini.com.br/redpill/
Como se formam e como atingem a especialização?
Existem várias etapas no processo de especialização de uma célula-tronco. A cada etapa, o seu potencial de desenvolvimento é reduzido, de forma que a célula-tronco unipotente não seja capaz de se diferenciar em tantos tipos de células quanto pluripotente.
Os mecanismos que levam à diferenciação e especialização em um tecido específico ainda não foram totalmente elucidados, embora em laboratório já seja possível oferecer estímulos como a adição de fatores de diferenciação através de experimentos in vitro (VENKEI; YAMASHITA, 2018).
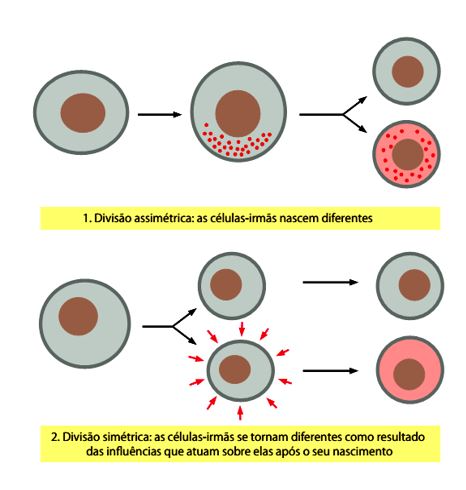
Muito se tem falado sobre a ideia de que a divisão celular assimétrica é uma característica definidora das células-tronco que permite que elas simultaneamente se perpetuem (pela autorrenovação) e gerem uma progênie diferenciada.
No entanto, muitas células-tronco podem se dividir simetricamente, principalmente quando se expandem em número durante o desenvolvimento ou após uma lesão. Assim, a divisão assimétrica não se faz necessária para a identidade das células-tronco; trata-se, no entanto, de uma ferramenta para a manutenção de números adequados de descendentes.
O uso facultativo das divisões simétricas ou assimétricas pode ser uma estratégia adaptativa para a capacidade regenerativa dos tecidos adultos (MORRISON; KIMBLE, 2006).
Os telômeros são estruturas proteicas e formadas por DNA não-codificante localizados nas extremidades dos cromossomos para prevenir o desgaste do conteúdo genético ao longo das replicações, sendo sua diminuição associada ao envelhecimento celular.
Em células normais e tumorais em proliferação, o comprimento do telômero é regulado pela alta atividade da enzima telomerase. Na ausência desse mecanismo, a manutenção do tamanho do telômero envolve um mecanismo de alongamento alternativo dos telômeros (ARSENIS et al., 2017).
Um estudo envolvendo células-tronco de camundongos, com alta carga proliferativa, avaliou o efeito da irradiação gama sobre a expressão e ação da enzima telomerase, revelando diminuição ou mesmo ausência de atividade (VYSOTSKAYA et al., 2020).
Aplicações terapêuticas:
As terapias celulares utilizam as habilidades clonogênicas inerentes da própria célula-tronco, onde são empregados estímulos específicos para programar a sua diferenciação em um tipo celular de interesse, visando à regeneração ou até mesmo a substituição de um tecido lesado (FODOR, 2003; ZAKRZEWSKI et al., 2019).
As mais recentes aplicações terapêuticas empregam, por exemplo, as células-tronco derivadas do tecido adiposo (ASC), do inglês adipose-derived stem cells, em ensaios pré-clínicos de regeneração tecidual óssea, tendo em vista a sua fácil obtenção que, apesar de invasiva, é remanescente de procedimentos estéticos realizados rotineiramente.
Outras particularidades as tornam atrativas, tais quais: a considerável plasticidade, adequada cinética de proliferação e suas propriedades tróficas – como a secreção de substâncias bioativas que atuam de forma parácrina, ou seja, atuam localmente nas células vizinhas (BARBA; DI TARANTO; LATTANZI, 2017; TAJIMA; TOBITA; MIZUNO, 2018).
Como alternativa ao transplante no caso de falência em decorrência de tumores, infecção viral, cirrose e outras causas, o emprego de células-tronco embrionárias apresentou resultados promissores na regeneração hepática em testes in vitro e in vivo (KOPP; GROMPE; SANDER, 2016; VOLAREVIC et al., 2014; WANG et al., 2019).
O campo das doenças neurodegenerativas também é beneficiado pela ampla utilização da terapia com as células-tronco embrionárias, no entanto, além na imunorejeição, já foi relatada a produção de teratoma após sua injeção (ARNHOLD et al., 2004).
Alternativamente, as CTA tem mostrado excelentes resultados considerando o seu desenvolvimento limitado; especialmente com a recente modificação genética para superexpressão de genes das CTE pelas CTA, aumentando assim seu potencial de desenvolvimento e a capacidade proliferativa, permitindo principalmente a sua diferenciação em células-tronco neurais (DENG et al., 2006; SUGAYA; VAIDYA, 2018).
Outras desordens como doenças cardiovasculares e doença de Parkinson são alvo de estudos para terapia com células-tronco, considerando que dependendo da fase da doença podem tornar-se incapacitantes e levarem à morbidade.
Desde o primeiro transplante cardíaco em humanos, foram utilizadas células-tronco de diversas origens, como as derivadas da medula óssea e as embrionárias, além dos progenitores cardíacos.
No entanto, os resultados obtidos em estudos clínicos foram inconsistentes devido à limitação do remodelamento cardíaco (MÜLLER; LEMCKE; DAVID, 2018; RIKHTEGAR et al., 2019).
Já para a doença de Parkinson que só dispõe de tratamento para atenuação dos sintomas, a terapia de substituição por células-tronco promete restabelecer a funcionalidade do sistema neuronal afetado, oferecendo alguma qualidade de vida e melhora ao paciente.
Estudos recentes se mostraram promissores, pois os novos neurônios dopaminérgicos do mesencéfalo foram capazes de restaurar a neurotransmissão e de recuperar funcionalmente o sistema afetado (LIU; CHEUNG, 2020).
Dentre tantas vantagens e aplicações, ainda é importante mencionar que é desafiador encontrar uma fonte satisfatória dessas células (JIN, 2017).
Além da barreira da disponibilidade, apresentam risco de imunorejeição no caso de não serem de fontes autólogas (BRADLEY; BOLTON; PEDERSEN, 2002); no entanto, as dificuldades do processo não suplantam os inúmeros benefícios e os resultados concretos já descritos para as “células-tronco de nova geração” (KIMBREL; LANZA, 2020).
Tenha acesso a conteúdos atualizados e práticos dentro da comunidade Redpill –https://drvitorazzini.com.br/redpill/
Referências:
- ARNHOLD, S. et al. Neurally selected embryonic stem cells induce tumor formation after long-term survival following engraftment into the subretinal space. Investigative ophthalmology & visual science, v. 45, n. 12, p. 4251–4
- ARSENIS, N. C. et al. Physical activity and telomere length: Impact of aging and potential mechanisms of action. Oncotarget, v. 8, n. 27, p. 45008–45019, jul. 2017. BAKER, C. L.; PERA, M. F. Capturing Totipotent Stem Cells. Cell stem cell, v. 22, n. 1, p. 25–34, jan. 2018.
- BARBA, M.; DI TARANTO, G.; LATTANZI, W. Adipose-derived stem cell therapies for bone regeneration. Expert opinion on biological therapy, v. 17, n. 6, p. 677–689, jun. 2017.
- BRADLEY, J. A.; BOLTON, E. M.; PEDERSEN, R. A. Stem cell medicine encounters the immune system. Nature reviews. Immunology, v. 2, n. 11, p. 859–871, nov. 2002.
- CLEVERS, H. STEM CELLS. What is an adult stem cell? Science (New York, N.Y.), v. 350, n. 6266, p. 1319–1320, dez. 2015.
- DE MIGUEL-BERIAIN, I. The ethics of stem cells revisited. Advanced drug delivery reviews, v. 82–83, p. 176–180, mar. 2015.
- DENG, Y.-B. et al. Implantation of BM mesenchymal stem cells into injured spinal cord elicits de novo neurogenesis and functional recovery: evidence from a study in rhesus monkeys. Cytotherapy, v. 8, n. 3, p. 210–214, 2006.
- FODOR, W. L. Tissue engineering and cell based therapies, from the bench to the clinic: the potential to replace, repair and regenerate. Reproductive biology and endocrinology : RB&E, v. 1, p. 102, nov. 2003.
- ILIC, D.; OGILVIE, C. Concise Review: Human Embryonic Stem Cells-What Have We Done? What Are We Doing? Where Are We Going? Stem cells (Dayton, Ohio), v. 35, n. 1, p. 17–25, jan. 2017.
- JIN, J. Stem Cell Treatments. JAMA, v. 317, n. 3, p. 330, jan. 2017.
- KIMBREL, E. A.; LANZA, R. Next-generation stem cells – ushering in a new era of cell-based therapies. Nature reviews. Drug discovery, v. 19, n. 7, p. 463–479, jul. 2020.
- KOLIOS, G.; MOODLEY, Y. Introduction to stem cells and regenerative medicine. Respiration; international review of thoracic diseases, v. 85, n. 1, p. 3–10, 2013.
- KOPP, J. L.; GROMPE, M.; SANDER, M. Stem cells versus plasticity in liver and pancreas regeneration. Nature cell biology, v. 18, n. 3, p. 238–245, mar. 2016.
- LEMISCHKA, I. R. Stem cell biology: a view toward the future. Annals of the New York Academy of Sciences, v. 1044, p. 132–138, jun. 2005.
- LIU, Z.; CHEUNG, H.-H. Stem Cell-Based Therapies for Parkinson Disease. International journal of molecular sciences, v. 21, n. 21, out. 2020.
- MIKI, T. Stem cell characteristics and the therapeutic potential of amniotic epithelial cells. American journal of reproductive immunology (New York, N.Y. : 1989), v. 80, n. 4, p. e13003, out. 2018.
- MORRISON, S. J.; KIMBLE, J. Asymmetric and symmetric stem-cell divisions in development and cancer. Nature, v. 441, n. 7097, p. 1068–1074, jun. 2006.
- MÜLLER, P.; LEMCKE, H.; DAVID, R. Stem Cell Therapy in Heart Diseases – Cell Types, Mechanisms and Improvement Strategies. Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology, v. 48, n. 6, p. 2607–2655, 2018.
- OHNUKI, M.; TAKAHASHI, K. Present and future challenges of induced pluripotent stem cells. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, v. 370, n. 1680, p. 20140367, out. 2015.
- RIKHTEGAR, R. et al. Stem cells as therapy for heart disease: iPSCs, ESCs, CSCs, and skeletal myoblasts. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, v. 109, p. 304–313, jan. 2019.
- SUGAYA, K.; VAIDYA, M. Stem Cell Therapies for Neurodegenerative Diseases. Advances in experimental medicine and biology, v. 1056, p. 61–84, 2018.
- TAJIMA, S.; TOBITA, M.; MIZUNO, H. Current status of bone regeneration using adipose-derived stem cells. Histology and histopathology, v. 33, n. 7, p. 619–627, jul. 2018.
- VENKEI, Z. G.; YAMASHITA, Y. M. Emerging mechanisms of asymmetric stem cell division. The Journal of cell biology, v. 217, n. 11, p. 3785–3795, nov. 2018.
- VOLAREVIC, V. et al. Concise review: Therapeutic potential of mesenchymal stem cells for the treatment of acute liver failure and cirrhosis. Stem cells (Dayton, Ohio), v. 32, n. 11, p. 2818–2823, nov. 2014.
- VYSOTSKAYA, O. V et al. [Telomerase activity, mTert gene expression and the telomere length in mouse mesenchymal stem cells in the late period after γ- and γ,n-irradiation and in the tumors developed from these cells]. Biomeditsinskaia khimiia, v. 66, n. 3, p. 265–273, maio 2020.
- WANG, J. et al. Stem Cell-Based Therapies for Liver Diseases: An Overview and Update. Tissue engineering and regenerative medicine, v. 16, n. 2, p. 107–118, abr. 2019.
- ZAKRZEWSKI, W. et al. Stem cells: past, present, and future. Stem cell research & therapy, v. 10, n. 1, p. 68, fev. 2019.